Farmakologien er senest opdateret december 2024 og opdateres ikke mere. Siderne lukkes ned til juli 2025.
Indhold
Lægemidler og graviditet
- Årsager til fosterskader
- Generelle principper for hvordan fosterskader opstå
- Fosterets genotype og hvordan denne reagerer med miljøfaktorer
- Fosterets udviklingsstadium
- Fosterbeskadigende stoffer har et begrænset antal specifikke virkningsmekanismer i celler og væv i udvikling
- En unormal udvikling kan medføre fosterdød, misdannelser, væksthæmning eller funktionelle forstyrrelser
- Risikoen og sværhedsgraden af fosterskader øges med stigende dosis.
- Mængden af skadelige stoffer, som kan passere placenta.
Lægemidler og graviditet
Forældrenes første spørgsmål efter fødslen er ofte: Er barnet velskabt? Dette gør det umiddelbart klart, hvor vigtig bekæmpelsen af fosterskader er. Problemets alvor fremgår også af, at medfødte misdannelser og for tidlig fødsel er de væsentligste årsager til spædbørnsdødelighed omkring fødselstidspunktet.
Selv om mange lægemidler næppe i sig selv indebærer en risiko for fosterskader, er det uundgåeligt, at lægemidler på grund af thalidomidkatastrofen indgår i enhver diskussion om fosterskader. I begyndelsen af 60’erne nåede thalidomid, et mildtvirkende sove- og beroligende middel, at blive årsag til, at flere tusinde børn fødtes med svære misdannelser, bl.a. i form af næsten manglende arme, inden man opdagede årsagssammenhængen. Siden den tid har lægemidlers risiko for teratogen virkning tiltrukket sig en særlig opmærksomhed.
Ved medicinsk behandling af de fleste lidelser i graviditeten er frygten for lægemiddelfremkaldte misdannelser dog overdreven, og i dag indgår brug af lægemidler som en vigtig del af obstetrikken. En fejlagtig eller overdreven frygt for at behandle gravide kvinder med lægemidler kan medføre utilstrækkelig behandling, unødvendige lidelser for den gravide eller abort af fuldstændig normale børn efter medicinsk behandling. Men på den anden side er vor viden om risikoen ved brug af lægemidler til gravide på nogle punkter fortsat mangelfuld, specielt hvad angår andre uønskede virkninger end misdannelser. Vor viden om lægemidlers langsigtede betydning for barnets funktion, mentale og motoriske udvikling er kun sporadisk belyst.
Epidemiologiske studier tyder på, at gravide indtager flere lægemidler end ikke-gravide i samme aldersgrupper. Således viser de fleste nyere undersøgelser, at mindst halvdelen har indtaget et eller flere lægemidler under graviditeten, men ofte er der tale om adskillige lægemidler. Ifølge en fransk undersøgelse (8) indtages hyppigst svage analgetika og antibiotika, dernæst kommer lægemidler mod forstoppelse, kvalme eller halsbrand. En gruppe af gravide har brug for kontinuert medicinsk behandling pga kroniske sygdomme eller disposition for svære svangerskabskomplikationer, fx diabetes mellitus, epilepsi eller disposition til tromboemboliske komplikationer.
Undersøgelser (9) viser også, at op til 20 % af gravide i 1. trimester udsættes for mindst 1 lægemiddel med en kendt risiko for fosterbeskadigende effekt. Men forbruget af potentielt farlige lægemidler var mindre i 1. trimester end i perioden før graviditeten, og forbruget aftog i løbet af graviditeten. En dansk undersøgelse (14) viser et stigende forbrug af antibiotika og antidepressiva blandt førstegangsgravide. Over en 20-årig periode (1998-2018) viser en dansk undersøgelse (20) et stigende forbrug af ordinerede lægemidler til gravide, som skyldes flere gravide med kroniske sygdomme.
En norsk undersøgelse (11,12) viser, at gravide generelt er positive over for brug af lægemidler under graviditet, og mener at de er sikre at bruge. Men samtidig overvurderer gravide risikoen for forsterskader. Førstegangsgraviditet, høj alder, høj uddannelse og fravalg af lægemiddelforbrug under graviditet karakteriserer gravide med høj opfattelse af risiko. Nogle, især lavtuddannede, betragter generelt medicin som skadelig og mener, at risikoen ved naturmedicin er mindre.
En svensk undersøgelse (17, 18) bekræfter, at gravide er meget opmærksomme på mulige ricisi ved indtagelse af lægemidler under graviditet og også, at de overestimerer risikoen. En stor del af gravide med en kronisk lidelse afstår fra at bruge vigtig medicin, fx 38,7% med depression og 8,9% med en sygdom, hvor medicinsk behandling er nødvendig eller stærkt rekommenderet. Ca. halvdelen af kvinderne havde bekymringer om føtale misdannelser ved brug af lægemidler under graviditet. Heldigvis var tilliden til rådgivning fra sundhedsprofessionelle stor.
1. Årsager til fosterskader
Fagområdet teratologi omfatter studiet af medfødte misdannelser. Ved en misdannelse forstår vi i dag enhver skade – morfologisk, biokemisk eller adfærdsmæssig – der er fremkaldt under fosterudviklingen, og som først viser sig efter fødslen eller eventuelt senere. Et lægemiddel eller en anden faktor, der kan fremkalde en misdannelse, har altså teratogen egenskab.
Hyppigheden af medfødte misdannelser skønnes at være 2-3 procent. Medfødte defekter skyldes sædvanligvis flere faktorer og er ofte følgen af et samspil mellem arv og miljø. I mange tilfælde er årsagerne til fosterskader ukendte. Der er en betydelig usikkerhed, når man skal vurdere, om en bestemt påvirkning under graviditeten øger hyppigheden af misdannelser. Det skønnes, at under 1% af alle medfødte misdannelser skyldes lægemiddelpåvirkning.
Yderligere vanskeliggøres vurderingen af, at graviditeten ikke kan betragtes som en enhed, idet et stof med kendt fosterbeskadigende effekt måske skal udøve sin virkning inden for en snævrere periode af graviditeten for at være årsag til en teratogen effekt. Ofte er det meget vanskeligt at tidsfæste en bestemt lægemiddelpåvirkning.
Mange lægemidler, som har været anvendt i årevis til millioner af patienter, føler man sig dog ret sikre på med hensyn til manglende fosterbeskadigende effekt. For andre lægemidler, hvor en lille hyppighed af en specifik fosterbeskadigelse er konstateret, kan det være svært at bedømme, om det i virkeligheden er lægemiddelterapien eller selve sygdommen, der er årsag eller om det måske er sygdom plus lægemiddel, man skal have opmærksomheden rettet imod. Der er altså tale om flere årsagsbetingede faktorer, og i denne forbindelse kan det være svært helt at frikende noget lægemiddel.
2. Generelle principper for hvordan fosterskader opstår
Følgende 6 generelle principper for teratologi findes:
- Fosterets genotype og hvordan denne reagerer med miljøfaktorer.
- Fosterets udviklingsstadium.
- Fosterbeskadigende stoffer har et begrænset antal specifikke virkningsmekanismer i celler og væv i udvikling.
- En unormal udvikling kan medføre fosterdød, misdannelser, væksthæmning eller funktionelle forstyrrelser.
- Risikoen og sværhedsgraden af fosterskader øges med stigende dosis.
- Mængden af skadelige stoffer, som kan passere placenta.
1. Fosterets genotype og hvordan denne reagerer med miljøfaktorer
Arvelige egenskaber bestemmer i høj grad fosterets følsomhed for fosterbeskadigende stoffer. Årsagerne til fosterskader er et samspil mellem genetiske og miljømæssige faktorer. For eksempel kan glukortikoider fremkalde ganespalte hos mus, men næppe hos andre pattedyr. Hos mennesker menes glukokortikoider at kunne øge risikoen for læbe/ganespalte i familier, hvor der er arvelig disposition for denne defekt.
Mennesker og højere aber er følsomme for thalidomids fosterbeskadigende effekt, mens kun få stammer af mus og rotter lader sig påvirke.
2. Fosterets udviklingsstadium
Under præimplantationsperioden, dvs. de første 2 uger efter konceptionen, er blastocysten almindeligvis ret modstandsdygtig over for påvirkninger af lægemidler. Udsættes fosteret for en skadelig påvirkning i denne periode, fører dette i reglen til abort, eller fosteret overlever med en let forsinket udvikling (embryotoksisk effekt). I væv fra aborterede fostre er der en stor hyppighed af anomalier.
I den følgende periode, kaldet organogenesen, 13-56 dage efter konceptionen, er fosteret særlig følsomt for skadelige påvirkninger, idet de forskellige organer og systemer uddifferentieres i dette tidsrum. Fx er følsomheden for nervesystemet størst 15-25 dage efter konceptionen, for hjertet 20-40 dage og for lemmerne 24-46 dage. Derfor bør lægemidler kun gives på tvingende indikationer til gravide i denne periode, og man bør foretrække et i mange år velkendt og sikkert præparat.
Visse organtyper er ikke færdigdannet i 1. trimester. Dette gælder fx kønskirtlerne, tænderne og centralnervesystemet. Sværere misdannelser opstår oftest i tidlige udviklingsstadier, mens mindre defekter kan opstå, så længe der sker en differentiering og udvikling i et organ.
3. Fosterbeskadigende stoffer har et begrænset antal specifikke virkningsmekanismer i celler og væv i udvikling
Nogle teratogene stoffer fremkalder genmutationer, ændringer i nukleinsyrernes struktur og funktion, kromosombrud og påvirkning af mitosen. Andre virkningsmekanismer er ændret energitilførsel, iltmangel, dannelse af skadelige frie radikaler, membranforandringer, osmotisk uligevægt og enzymhæmning eller virkning som antimetabolit, fx folinsyreantagonister, hvor fosteret berøves vigtige næringsstoffer.
Man har ikke kunnet konstatere nogen sammenhæng mellem stoffets kemiske struktur og dets teratogene effekt. Ej heller er der nogen relation mellem den farmakologiske og den teratogene virkning. Både adrenerge og kolinerge receptorer er påvist hos humane fostre fra 8.-10. uge, men hvad dette betyder for lægemiddelvirkningen på fosteret er uafklaret. Teratogene stoffer er endvidere karakteriseret ved, at de normalt ikke er giftige for moderen.
4. En unormal udvikling kan medføre fosterdød, misdannelser, væksthæmning eller funktionelle forstyrrelser
a. Fosterdød
En forholdsvis stor procentdel af alle graviditeter ender med abort eller dødfødsel. Udstødes et dødt foster før 28. uge, registreres det som en abort, og efter denne tid en dødfødsel. Af de registrerede graviditeter regner man med, at 10-15 % ender med fosterdød. Dertil kommer de, der udstødes så tidligt, at graviditeten ikke registreres, og som derved kun opfattes som forsinket menstruation. Årsagerne til fosterdød kan være mange, men de stoffer, der kan føre til misdannelser, kan normalt også give fosterdød.
b. Misdannelser
Misdannelser fremkaldes hovedsageligt i 1. trimester, men registreres som regel ikke under graviditeten og ses først ved fødslen.
Der findes både lette og svære misdannelser. Svære misdannelser omfatter de skader, der ofte kan medføre invaliditet eller død, og som udgør en trediedel af de registrerede misdannelser. Disse kan eksempelvis være hydrocephalus, anencephali, spina bifida, læbe/ganespalte, brok, hjertelidelser og Downs syndrom. De lettere misdannelser udgør de resterende 2 tredjedele af registrerede misdannelser og kan være omphalocele, navlebrok, vandbrok, sammenvoksning af fingre og tæer, fodstillingsfejl. De lettere misdannelser kan let korrigeres eller vil ikke genere personen gennem livet.
Forskellige teratogene påvirkninger kan fremkalde samme slags misdannelser, og et bestemt teratogen kan give flere forskellige misdannelser samtidig, et syndrom. Som eksempel kan nævnes det føtale alkoholsyndrom og det føtale valproatsyndrom.
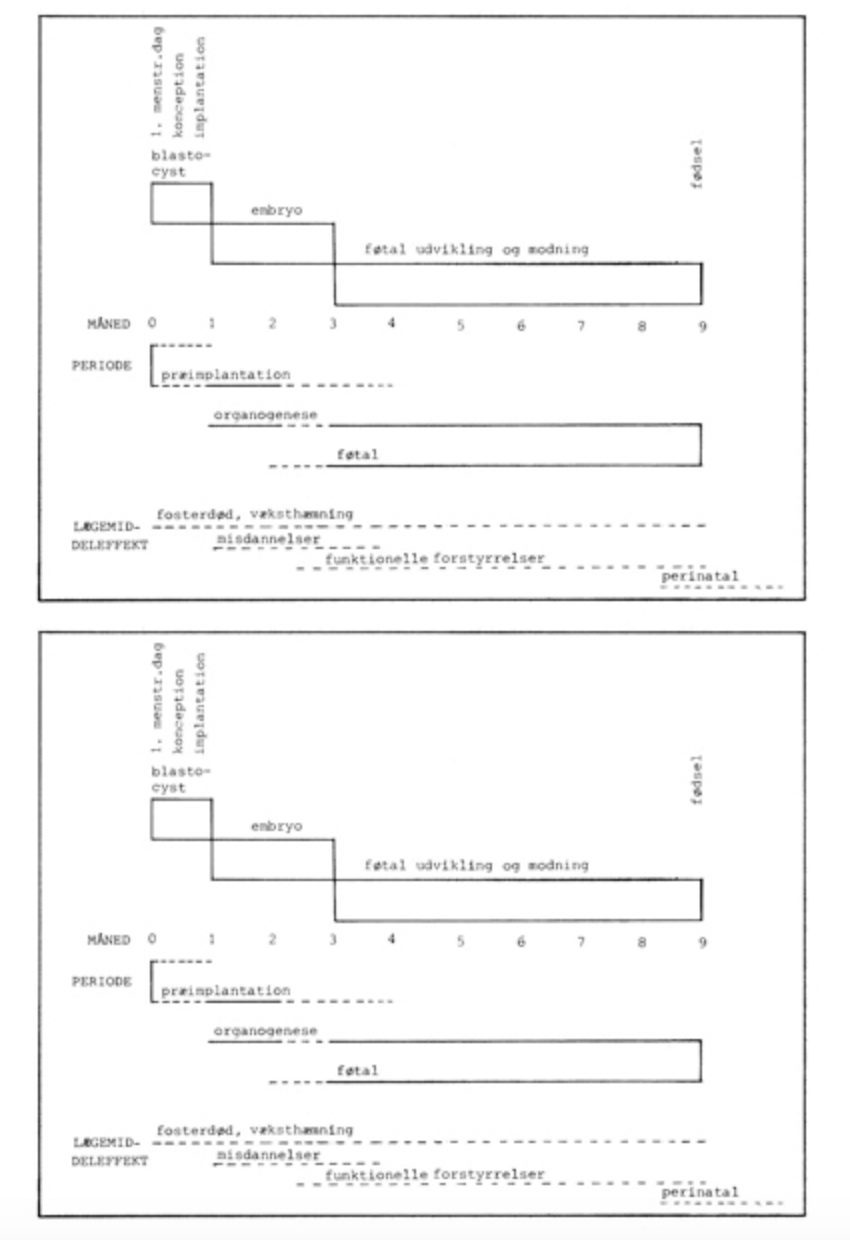
c. Væksthæmning
Lav fødselsvægt har ofte negativ betydning, idet der er en sammenhæng med øget neonatal mortalitet. Mange miljøgifte kan give væksthæmning, fx DDT, nikotin og alkohol.
d. Funktionelle forstyrrelser
Funktionelle forstyrrelser er en anden type fosterskade end de rene misdannelser. Dette kan fx være synsskader, høreskader, neurologiske skader (fx cerebral parese) og intelligensdefekter. Denne type af skader kan være fremkaldt i fosterstadiet og skyldes forandringer i organernes udvikling, selv om organernes udseende kan være normale.
De fremkaldes som regel i 2. og 3. trimester og er ofte bivirkninger, som også kan ses hos voksne. Det kan være blødning hos nyfødte efter behandling med vitamin-K antagonister, høreskader efter aminoglykosider og tandskader på grund af tetracykliner.
Funktionelle forstyrrelser kan også være fremkaldt omkring fødselstidspunktet (perinatal effekt), fx kan Fenemal og opioidanalgetika give respirationsinsufficiens hos den nyfødte. Abstinenssymptomer er observeret hos nyfødte af narkotikamisbrugende mødre.
Endvidere kan sulfonamider forværre den nyfødtes tendens til gulsot (ikterus), idet kraftigt proteinbundne lægemidler kan fortrænge bilirubin fra serumproteiner og dermed øge koncentrationen af det toksiske affaldsprodukt bilirubin.
Endvidere synes fosterets miljø og ernæringstilstand at være afgørende for senere sygelighed. Flere nyere undersøgelser har sandsynliggjort, at der er en sammenhæng mellem føtal vækst og vækst i barnealderen samt risikoen for udvikling af kroniske sygdomme i voksenalderen som fx akut myokardieinfarkt, forhøjet blodtryk, type 2-diabetes, lungesygdomme og fedme. På basis af disse fund har man fremsat programmeringshypotesen, der siger, at indgreb i kritiske perioder af organers udvikling kan medføre permanente skader.
5. Risikoen og sværhedsgraden af fosterskader øges med stigende dosis.
Næsten alle erfaringer i teratologi tyder på, at unormal udvikling kun fremkaldes, når dosis overstiger en bestemt tærskel, dvs. der findes et lavere dosisområde, hvor der ikke er teratogene virkninger.
Endnu er erfaringerne for væksthæmning og funktionelle forstyrrelser dog begrænsede. Den typiske dosis/virkningskurve for teratogene virkninger er brat stigende. Men der er i høj grad en indirekte sammenhæng mellem det kritiske tidspunkt i fosterudviklingen og den kritiske dosis, idet dosis ikke behøver at være så stor, hvis man på et kritisk tidspunkt i den organdannende periode udsættes for et bestemt teratogent stof.
Endvidere er risikoen for fosterskader også afhængig af varigheden af den teratogene påvirkning. Jo længere behandlingstid eller virkningstid af lægemidlet, jo større er sandsynligheden for, at der gribes ind i udviklingen af et bestemt organ.
6. Mængden af skadelige stoffer, som kan passere placenta.
Dette afhænger igen af fysisk/kemiske egenskaber ved lægemidler og fysiologiske forhold hos moder og foster, se afsnittet om placentapassage og fosterets farmakologi.
