Klassifikation
Selvom der skelnes mellem flere tilstande – hypertension, præeklampsi, HELLP mm. (se Tabel 1: ‘Klassifikation af de hypertensive tilstande i graviditeten’ på jordemoderforeningen.dk) – opfattes disse som udtryk for et spektrum i ét samlet syndrom med stor variation i præsentation, symptomer og debuttidspunkt. Gennem tiden er definitioner og klassifikationer blevet ændret inden for dette spektrum. Dette gør det svært at håndtere kvinder med præeklampsi i både forskning og klinik, og svært at sammenligne resultater over tid og sted. Til forskningsbrug bør man stringent benytte definitionerne, men i klinikken have respekt for den store variation og til tider hastige udvikling i tilstanden, hvilket betyder, at flere gravide vil blive håndteret som havende præeklampsi uden at opfylde kriterierne (2).
Risikofaktorer og prædiktion
Der er flere prægravide faktorer, der øger risikoen for præeklampsi. Overskriften for disse er de samme som for hjertekar-sygdomme: inflammation med oxidativt stress, nedsat insulinfølsomhed, endotel dysfunktion og trombosetendens. Eksempelvis vil en familiær eller personlig anamnese med præeklampsi og hjertekar-sygdomme, nyre-insufficiens, overvægt og diabetes, inflammatoriske sygdomme – fx systemisk lupus – øge risikoen betydeligt. I graviditeten vil placentale forhold med flerfold og kromosomale trisomier også bidrage til risikoen.
Ved at kombinere anamnesen med målinger af bl.a. blodtryk, ultralydsmåling af flow til uterus og blodprøver for PAPP-A, PlGF og sFlt-1 kan en egentlig risiko for præeklampsi beregnes allerede i 1. trimester. Der er flere forskellige algoritmer tilgængelige, men fælles for dem er en høj præcision for tidlig præeklampsi og en lav for sen præeklampsi (7). Denne risiko kan herefter benyttes til at rådgive om brug af profylakse i form af aspirin.
Komplikationer
Præeklampsi ses hyppigt sammen med føtal væksthæmning, men også fosterdød og abruptio; disse tilstande er samlet i begrebet ‘placenta-insufficiens’. Da patologien til præeklampsi er en generel dysfunktion af endothelet i karrene, vil der kunne opstå komplikationer overalt i kroppen (se figur 1). For klinikeren er det vigtigt at være opmærksom på disse komplikationer, når man behandler kvinder med begyndende præeklampsi. De fleste af disse er dog sjældne, men alvorlige og kan forebygges.
Kardiovaskulært er hypertensionen dominerende komplikation, men lungeødem ses også som en del af en påvirket kar-permeabilitet og kardiel dysfunktion og sjældent også egentlig peripartum kardiomyopati (PPCM). Renalt ses hyppigst proteinuri, der skyldes den glomerulære endotheliose8, der også øger risikoen for akut nyreinsufficiens (AKI) – specielt ved samtidig hypovolæmi ved fx post-partum blødning. Den almindelige graviditetsbetingede hyper-koagulabilitet, der klinisk ses ved øget forekomst af venøse tromber (9), er ved præeklampsi mere udtalt. Specielt ved HELLP kan der underliggende være trombotisk trombocytopenisk purpura (TTP), og i forsømte eller aggressive tilstande kan der udvikles dissemineret intravaskulær koagulation (DIC). Hepatisk kan ses forhøjet transaminaser, der hyppigst optræder isoleret eller som del af intrahepatisk cholestase (ICP) med forhøjet galdesalte, men også som del af triaden i HELLP, hvor der sjældent, men alvorligt, kan forekomme periportal hæmoragisk nekrose og subkapsulære infarkter. Neurologisk er blod-hjerne-barrieren og den cerebrale autoregulation ændret, og ved præeklampsi er dette yderligere forværret, således at blodgennemstrømningen til det cerebrale gebet er uregelmæssig. Eklampsi antages at være udløst af en blanding mellem tiltagende vasogent spasme (RCVS) førende til lokalt lavere gennemstrømning, hypoxi og cytotoxisk ødem, samt en form af hypertensiv encephalopati med øget ekstra-vasal ødem (PRES). Hæmoragisk apoplexi er den hyppigste dødsårsag hos kvinder med præeklampsi, specielt ved hypertensiv krise. Sinus-vene trombose (CSVT) ses også hyppigere ved præeklampsi og bør overvejes ved pludselig hovedpine.
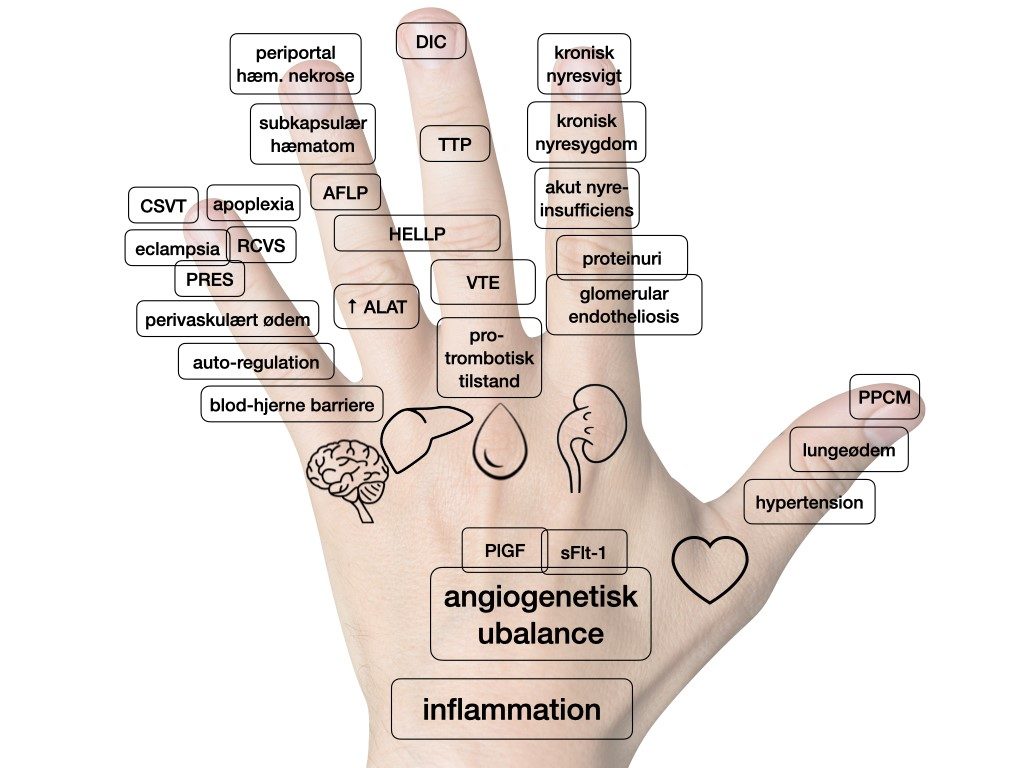
| Figur 1: Komplikationer til præeklampsi relateret til hjerne, lever, blod, nyrer og hjerte samt generelle komplikationer. Forklaring på forkortelser: PPCM peripartum cardiomyopati, DIC dissimineret intravasculær coagulopati, TTP trombotisk trombocytopenisk purpura, VTE venøs trombo-emboli, ALAT alanin- aminotransferase, HELLP haemolysis, elevated liver enzymes, low platelets, AFLP acute fatty liver of pregnancy, PRES posterior reversible encephalopaty syndrome, RCVS reversible cerebral vasoconstriction syndrome og CSVT cerebral sinus venosus trombose. PlGF Placental Growth Factor; sFlt-1 Soluble fms-like tyrosine kinase-1. |
Profylakse og behandling
En egentlig behandling af præeklampsi findes endnu ikke, men flere strategier og studier er i gang omkring ændring i balancen af angiogenese-proteinerne ved tidlig præeklampsi (10-12). Strategien er derfor fortsat at nedsætte risikoen for komplikationer og ultimativt forløse kvinden. Men selv efter forløsning vil sygdommen ulme videre systemisk i endothelet efterfølgende, og i nogle tilfælde kan præeklampsi og komplikationerne debutere efter forløsning. Forebyggelse af derfor stadig vigtig.
De sidste årtiers forskning synes at bekræfte, at motion før og tidligt i graviditeten nedsætter risiko for præeklampsi med ca. 35%. Kvinder, der spiser “hjerte-venligt kost”, synes også at have en nedsat risiko. Supplement med calcium ≥1g per dag før graviditeten nedsætter også risikoen13, specielt ved kvinder, der ikke indtager calciumholdig mad generelt. Interessant synes det, at kvinder med lav vitamin-D status har en øget risiko for præeklampsi, men supplement med vitamin-D – eller vitamin C eller E – ikke har vist nogen effekt på denne risiko.
Acetylsalicylsyre (ASA) har i flere studier vist sig at nedsætte risiko for tidlig, men ikke sen præeklampsi, såfremt det startes tidligt i graviditeten (14). I det seneste store randomiserede ASPRE-studie havde kvinder med en beregnet høj risiko for tidlig præeklampsi ved nakkefold-scanning en risikoreduktion fra 4.3% til 1.6% (OR 0.38) for præeklampsi før GA 37 uger ved at tage 150mg ASA ved aftentid fra ca. GA 14 uger (15).
Når først hypertension er diagnosticeret, er målet at reducere forekomsten af komplikationer for kvinden og fosteret/barnet: Her bruges antihypertensiva, magnesium, steroid og endeligt forløsning. Gennem de sidste årtier har der været en tendens til strammere regulering af blodtryk, og parallelt hermed er den maternelle dødelighed faldet. Der sigtes nu på et BT 110-140/80- 85mmHg (16). I Skandinavien accepterer man dog mange steder BT op til 150/100mmHg.
I Danmark bruges hovedsageligt peroralt metyldopa, labetolol og nifedipin som ligeværdige per orale præparater samt intravenøst labetolol og hydralazin ved hypertensive kriser. Dog lader nifedipin til bedst at kontrollere et akut højt blodtryk (17), mens metyldopa synes velegnet til kvinder med kronisk hypertension18, men kan øge risiko for “maternity blues” og depression (19).
De forskellige præparater virker på forskellige måder med stor individuel virkning. Metyldopa virker som central alfa-blokker indirekte gennem en nedsat sympaticus-tonus; labetalol er en kombineret alfa- og beta-antagonist; og nifedipin er en calciumkanal-antagonist. Hydralazin er en intravenøs vasodilatator med stor, men også uforudsigelig effekt, og man bør være opmærksom på maternel hypotension og føtale bradycardier (20). Alle disse præparater har været benyttet i flere årtier i obstetrikken og vurderes sikre.
Magnesiumsulfat bruges som både forebyggelse og behandling af eklampsi. Den forebyggende effekt er en reduktion af eklampsi fra 1.9% til 0.8% (OR 0.42) hos kvinder med præeklampsi (21). Samtidig beskytter magnesium også den præmature neonatale hjerne for risikoen for cerebral parese (22).
Antenatal corticosteroid benyttes som forebyggelse overfor neonatale komplikationer ift. præmaturitet før GA 34 uger, også ved præeklampsi (23). Der kan endvidere også overvejes steroid ifm. HELLP-syndrom (24).
Forløsning
Der ligger i obstetrikken en balance i hensynet til kvinden overfor barnet. Kvinden vil altid have lavere risiko for komplikationer til præeklampsi ved en umiddelbar forløsning; for barnet vil de neonatale risici afhængig af graden af præmaturitet. Tendensen de sidste 50 år er en tidligere forløsning med en nedsat perinatal mortalitet for foster/barn (25), men nyere studier betoner balancen i timingen for forløsningen. Før GA 34 uger bør man afvente forløsning ift. barnets risiko for komplikationer til præmaturitet; ved svær organpåvirkning eller ukontrollabelt BT bør man dog forløse efter stabilisering. Mellem GA 34-36 uger bør man ved præeklampsi uden svære påvirkninger afvente forløsning af hensyn til barnet. I et studie var umiddelbar forløsning ikke beskyttende for kvinden, men der sås forhøjede risici for barnet (26). I et andet studie var der færre komplikationer hos kvinden, men dog også højere risici for barnet (27). Ved tegn til svær organpåvirkning bør man forløse umiddelbart; vaginal fødsel bør overvejes, hvis tilstanden tillader det. Efter GA 37 uger vil en umiddelbar forløsning medføre en lavere risiko for maternelle komplikationer (31% vs. 44%; OR 0.71) – overvejende pga. svær hypertension – og ingen øget risici for børnene, men dog lavere fødselsvægt28. Kvinder med stabil kronisk hypertension kan overvejes at lade gå til terminen.
Man må i beslutningen om forløsning også overveje de lokale forhold – herunder pædiatriske kompetencer – og risici for komplikationer og overveje overflytning til højt specialiseret fødested. Flere steder i verden bruges måling af de angiogenetiske proteiner (PlGF og sFlt-1) til vurdering af risikoen for umiddelbare komplikationer (29) for at individualisere behandlingen og beslutningen om forløsning.
Efterforløbet
Præeklampsi er sjældent overstået lige ved forløsningen, og nogle kvinder kræver længerevarende behandling med antihypertensiva. Enkelte kommer slet ikke ud af behandlingen og går direkte over i en diagnose af essentiel hypertension. Senere i livet vil kvinder med tidligere præeklampsi have en forhøjet risiko for hjerte-kar-sygdomme (se figur 2), herunder essentiel hypertension, trombose og diabetes30, samt nefrit og for tidlig død. Der synes også at være en fire gange øget risiko for depression og PTSD i puerperiet (31).
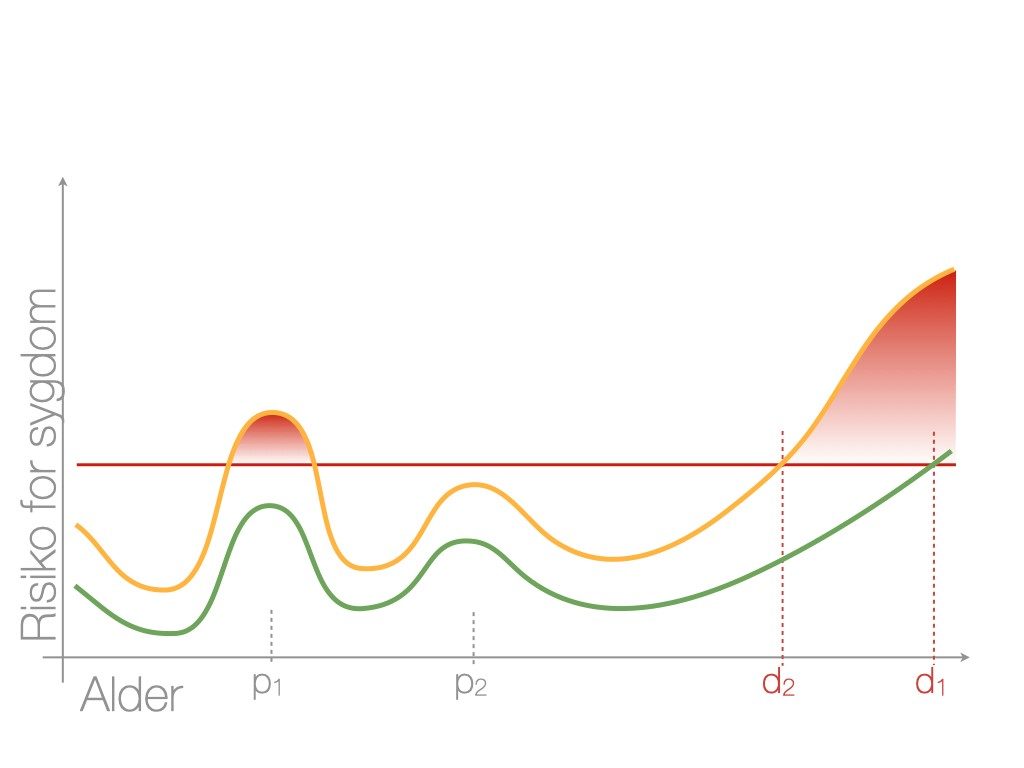
| Figur 2: Graviditeten som stress-test Forklaring: Figur 2 beskriver udviklingen af sygdom ift. alder og graviditet. Kvindens alder er vist på den vandrette akse, og risikoen for sygdom, specielt hjertekar-sygdom, fx hypertension, på den lodrette akse. P1 og p2 repræsenterer henholdsvis første og anden graviditet med øget stress; d1 og d2 repræsenterer tidspunkterne for diagnosticering af sygdom, fx essentiel hypertension. Den røde linje repræsenterer tærsklen for sygdom; det røde område repræsenterer udvikling af sygdom. Linjerne grøn og gul repræsenterer to forskellige kvinders risikoprofil for hypertension gennem livet: Den ene kvinde (grøn) vil gennemgå to ukomplicerede graviditeter og få essentiel hypertension ved tidspunktet d1. Den anden kvinde (gul) vil have præeklampsi i første graviditet og få tidligere essentiel hypertension ved tidspunktet d2. (gengivet med tilladelse fra ’The vascular obstetrical syndrome’, disputats af Jacob Alexander Lykke, 2013). |
Ved en evt. ny graviditet vil der være en absolut risiko på 15-40% for gentagelse af præeklampsi (uden ASA profylakse) samt en øget risiko for andre obstetriske komplikationer som føtal væksthæmning, moderkageløsning og HELLP (32). Nogle kvinder vil også blive diagnosticeret med autoimmune tilstande som lupus (SLE) og antifosfolipid-syndrom (APS) efter en graviditet med tidlig svær præeklampsi (33).
Således hænger teorien om patofysiologien ved præeklampsi, hvor en nedsat “hjerte-kar-reserve” med et dysfunktionelt endothel er et stort element, sammen med udvikling af sygdom senere i livet. Man har derfor poetisk kaldt graviditet for en ‘stress-test for livet’.
| Om forfatteren: Jacob Alexander Lykke er overlæge, lektor, dr. med. Ansat på Rigshospitalet, obstetrisk klinik. Redaktion: Anne-Marie Kjeldset Referencer: 1. Kassebaum NJ, Bertozzi-Villa A, Coggeshall MS, Shackelford KA, Steiner C, Heuton KR, et al. Global, regional, and national levels and causes of maternal mortality during 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2014 Sep;384(9947):980–1004. 2. Brown MA, Magee LA, Kenny LC, Karumanchi SA, McCarthy FP, Saito S, et al. Hypertensive Disorders of Pregnancy: ISSHP Classification, Diagnosis, and Management Recommendations for International Practice. Hypertension. 2018 Jul;72(1):24–43. 3. Redman CW, Sargent IL. Latest Advances in Understanding Preeclampsia. Science. 2005 Jun 10;308(5728):1592–4. 4.Meah VL, Cockcroft JR, Backx K, Shave R, Stöhr EJ. Cardiac output and related haemodynamics during pregnancy: a series of meta-analyses. Heart. 2016 Apr 1;102(7):518–26. 5. Valensise H, Vasapollo B, Gagliardi G, Novelli GP. Early and Late Preeclampsia: Two Different Maternal Hemodynamic States in the Latent Phase of the Disease. Hypertension. 2008 Oct 13;52(5):873–80. 6. Levine RJ, Maynard SE, Qian C, Lim K-H, England LJ, Yu KF, et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med. 2004;350(7):672–83. 7. Poon LC, Shennan A, Hyett JA, Kapur A, Hadar E, Divakar H, et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre‐eclampsia: A pragmatic guide for first‐trimester screening and prevention. Int J Gynecol Obstet. 2019 May;145(S1):1–33. 8. Foster RR. The Importance of Cellular VEGF Bioactivity in the Development of Glomerular Disease. Nephron Exp Nephrol. 2009;113(1):e8–15. 9. Virkus RA, Løkkegaard E, Lidegaard Ø, Langhoff-Roos J, Nielsen AK, Rothman KJ, et al. Risk Factors for Venous Thromboembolism in 1.3 Million Pregnancies: A Nationwide Prospective Cohort. Zenclussen AC, editor. PLoS ONE. 2014 May 2;9(5):e96495. 10. Thadhani R, Hagmann H, Schaarschmidt W, Roth B, Cingoez T, Karumanchi SA, et al. Removal of Soluble Fms-Like Tyrosine Kinase-1 by Dextran Sulfate Apheresis in Preeclampsia. J Am Soc Nephrol. 2015 Sep 24;27(3):903–13. 11. Ahmed A, Williams D, Cheed V, Middleton L, Ahmad S, Wang K, et al. Pravastatin for early‐onset pre‐eclampsia: a randomised, blinded, placebo‐controlled trial. BJOG. 2020 Mar;127(4):478–88. 12. Spradley FT, Tan AY, Joo WS, Daniels G, Kussie P, Karumanchi SA, et al. Placental Growth Factor Administration Abolishes Placental Ischemia-Induced Hypertension. Hypertension. 2016;67(4):740–7. 13. Hofmeyr GJ, Lawrie TA, Atallah ÁN, Torloni MR. Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems. Cochrane Pregnancy and Childbirth Group, editor. Cochrane Database Syst Rev. 2018 Oct 1;10(10):CD001059. 14. Roberge S, Villa P, Nicolaides K, Giguère Y, Vainio M, Bakthi A, et al. Early Administration of Low-Dose Aspirin for the Prevention of Preterm and Term Preeclampsia: A Systematic Review and Meta-Analysis. Fetal Diagn Ther. 2012;31(3):141–6. 15. Rolnik DL, Wright D, Poon LC, O’Gorman N, Syngelaki A, de Paco Matallana C, et al. Aspirin versus Placebo in Pregnancies at High Risk for Preterm Preeclampsia. N Engl J Med. 2017 Aug 17;377(7):613–22. 16. Magee LA, von Dadelszen P, Rey E, Ross S, Asztalos E, Murphy KE, et al. Less-Tight versus Tight Control of Hypertension in Pregnancy. N Engl J Med. 2015 Jan 29;372(5):407–17. 17. Easterling T, Mundle S, Bracken H, Parvekar S, Mool S, Magee LA, et al. Oral antihypertensive regimens (nifedipine retard, labetalol, and methyldopa) for management of severe hypertension in pregnancy: an open-label, randomised controlled trial. Lancet. 2019 Sep;394(10203):1011–21. 18. Magee L, the CHIPS Study Group, Dadelszen P, Singer J, Lee T, Rey E, et al. Control of Hypertension In Pregnancy Study randomised controlled trial—are the results dependent on the choice of labetalol or methyldopa? BJOG. 2016 Jun;123(7):1135–41. 19. Wiciński M, Malinowski B, Puk O, Socha M, Słupski M. Methyldopa as an inductor of postpartum depression and maternal blues: A review. Biomed Pharmacother. 2020 Jul;127:110196. 20. Magee LA, Abalos E, von Dadelszen P, Sibai B, Walkinshaw SA. Control of hypertension in pregnancy. Curr Hypertens Rep. 2009 Dec;11(6):429–36. 21. Altman D, Carroli G, Duley L, Farrell B, Moodley J, Neilson J, et al. Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet. 2002 Jun 1;359(9321):1877–90. 22. Crowther CA, Middleton PF, Voysey M, Askie L, Duley L, Pryde PG, et al. Assessing the neuroprotective benefits for babies of antenatal magnesium sulphate: An individual participant data meta-analysis. Myers JE, editor. PLOS Med. 2017 Oct 4;14(10):e1002398. 23. Amorim MM, Santos LC, Faúndes A. Corticosteroid therapy for prevention of respiratory distress syndrome in severe preeclampsia. Am J Obstet Gynecol. 1999 May;180(5):1283–8. 24. Martin JN, Rose CH, Briery CM. Understanding and managing HELLP syndrome: The integral role of aggressive glucocorticoids for mother and child. Am J Obstet Gynecol. 2006 Oct;195(4):914–34. 25. Basso O, Rasmussen S, Weinberg CR, Wilcox AJ, Irgens LM, Skjaerven R. Trends in fetal and infant survival following preeclampsia. JAMA. 2006;296(11):1357–62. 26. Broekhuijsen K, van Baaren G-J, van Pampus MG, Ganzevoort W, Sikkema JM, Woiski MD, et al. Immediate delivery versus expectant monitoring for hypertensive disorders of pregnancy between 34 and 37 weeks of gestation (HYPITAT-II): an open-label, randomised controlled trial. Lancet. 2015;385(9986):2492–501. 27. Chappell LC, Brocklehurst P, Green ME, Hunter R, Hardy P, Juszczak E, et al. Planned early delivery or expectant management for late preterm pre-eclampsia (PHOENIX): a randomised controlled trial. Lancet. 2019 Sep;394(10204):1181–90. 28. Koopmans CM, Bijlenga D, Groen H, Vijgen SMC, Aarnoudse JG, Bekedam DJ, et al. Induction of labour versus expectant monitoring for gestational hypertension or mild pre-eclampsia after 36 weeks’ gestation (HYPITAT): a multicentre, open-label randomised controlled trial. Lancet. 2009 Sep 19;374(9694):979–88. 29. Zeisler H, Llurba E, Chantraine F, Vatish M, Staff AC, Sennström M, et al. Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med. 2016 Jan 7;374(1):13–22. 30. Lykke JA, Langhoff-Roos J, Sibai BM, Funai EF, Triche EW, Paidas MJ. Hypertensive Pregnancy Disorders and Subsequent Cardiovascular Morbidity and Type 2 Diabetes Mellitus in the Mother. Hypertension. 2009 May 11;53(6):944–51. 31. Porcel J, Feigal C, Poye L, Postma IR, Zeeman GG, Olowoyeye A, et al. Hypertensive disorders of pregnancy and risk of screening positive for Posttraumatic Stress Disorder: A cross-sectional study. Pregnancy Hypertens Int J Womens Cardiovasc Health. 2013 Oct;3(4):254–60. 32. Lykke JA, Paidas MJ, Langhoff-Roos J. Recurring complications in second pregnancy. Obstet Gynecol. 2009 Jun;113(6):1217–24. 33. Lin L-T, Wang P-H, Tsui K-H, Cheng J-T, Cheng J-S, Huang W-C, et al. Increased risk of systemic lupus erythematosus in pregnancy-induced hypertension: A nationwide population-based retrospective cohort study. Medicine (Baltimore). 2016 Jul;95(30):e4407. |

